Module 1
D’où provient l’énergie dont le muscle a besoin ?
Introduction
Ce module de formation en ligne introduit les connaissances scientifiques permettant de comprendre la provenance de l'énergie utilisée lors de la contraction et de l'activité musculaire.
Objectifs d'apprentissage :
- Comprendre d’où vient l’énergie biologique : du soleil à l’adénosine triphosphate (ATP)
- Définir comment la molécule d'ATP est synthétisée dans la mitochondrie et comment elle est utilisée dans l’organisme
- Expliquer le rôle central de l’ATP dans les échanges d’énergie des cellules de notre organisme
- Décrire les grandes lois de l’énergie en relation avec l’énergétique musculaire
- Expliquer comment l’énergie libérée par l’hydrolyse de l’ATP est utilisée lors de la contraction et l’activité musculaire
Glossaire de la leçon
Placer le pointeur de votre souris sur les termes ci-dessous pour lire les définitions
A : ADP, AMP, ATP, Autotrophes
C : Calorie
E : Endergonique, Energie libre « G » , Enthalpie , Entropie, Enzymes , Exergonique
F : Flux de l’énergie
H : Hétérotrophes , Hydrolyse
J : Joule
M : Métabolisme, Millimole, Molécule
P : Photosynthèse
T : Thermodynamique
V: Variations de l’énergie
1. D’où vient l’énergie dans notre biosphère ?
Du soleil à l’adénosine triphosphate (ATP)
Défi !
Définition
2. Comment la molécule d'ATP est synthétisée dans la mitochondrie et utilisée dans l’organisme ?
Crédit diapositive 1 : McArdle, Katch et Katch. Physiologie de l'activité physique. 4ème edition : Maloine/Edisem
3. Comprendre le rôle central de l’ATP dans les échanges d’énergie des cellules de notre organisme
Un peu d'exercice !
4. Décrire les grandes lois de l’énergie en relation avec l’énergétique musculaire
- INtroduction
- Premier principe
- Deuxième principe
- Exemple 1
- EXEMPLE 2
Afin de produire le travail indispensable à sa survie et à son évolution (travail mécanique, osmotique, chimique…) tout organisme vivant transforme, stocke, distribue et dégrade de l'énergie. La circulation et les transformations de l'énergie dont il est le siège, représentent son métabolisme.
A ce stade, il est difficile de poursuivre cette explication sans évoquer brièvement quelques uns des grands principes des équilibres thermodynamiques dont dépend la compréhension des différents phénomènes bioénergétiques du métabolisme au repos et au cours de l'exercice.
Le premier principe dit de conservation de l’énergie, établit que la quantité totale d'énergie d'un système et de son environnement reste constante. Bien que, ni créée ni détruite, l'énergie peut cependant subir des transformations d'une forme à une autre : la chaleur peut être transformée en énergie chimique, l'énergie chimique en énergie mécanique, l'énergie mécanique en électricité, l'électricité en lumière ou à nouveau en chaleur…
Le deuxième principe précise que toute forme d'énergie s’écoule de façon irréversible d'une source initiale où son potentiel de transformation et de travail est le plus élevé, vers une forme dégradée à partir de laquelle elle devient de plus en plus indisponible. Cette non disponibilité progressive est définie comme entropie.
C'est dans cet écoulement appelé flux de l’énergie, que les systèmes et organismes puisent leur propre énergie transformée en travail, stockée, distribuée et dégradée dans le sens de l'entropie générale.
Ce flux est irréversible, ceci signifie que, lorsqu'une forme d'énergie est libérée pour réaliser un travail par exemple, on ne peut en quelque sorte « remonter le courant » et revenir à la source initiale sans un apport conséquent d'énergie puisée à une autre source. Ce phénomène très répandu en biologie est défini comme couplage énergétique.
Imaginons une réserve d'eau située à une certaine hauteur. Lorsqu'une conduite est ouverte, l'eau de cette réserve s'y engouffre. Si rien ne l'arrête dans sa descente, elle peut s'écouler ainsi jusqu'au niveau de la mer où, progressivement, elle perd toute la vitesse liée à la hauteur de son écoulement initial.
De ce simple exemple, quatre notions fondamentales peuvent être dégagées :
- l'eau maintenue dans la réserve représente une source énergétique potentielle,
- libérée, elle peut s'écouler à une vitesse qui engendre un taux maximal d'énergie cinétique (liée au mouvement) jusqu'à ce que la réserve soit complètement vide,
- l'énergie cinétique peut être totalement perdue, lorsque l'écoulement se ralentit au niveau de la mer ou, au cours de son écoulement, elle peut être en partie convertie en d'autres formes d'énergie. Par exemple : elle est susceptible de faire tourner les palles d'une turbine (énergie mécanique) pour être convertie en électricité (énergie électrique) elle-même utilisée pour l'éclairage de nos villes et nos habitations (énergie lumineuse). Pour être convertie en d'autres formes, l'énergie a donc besoin d'être couplée à un générateur, ici la turbine.
- Dans sa descente, l'eau de la réserve libère de l'énergie. On dit qu'elle est exergonique (qui fournit de l'énergie). Au contraire, s'il fallait envisager un système de pompes pour remonter l'eau écoulée à la hauteur où se trouvait sa réserve initiale, il faudrait lui fournir de l'énergie. Le système serait dit alors endergonique (qui consomme de l'énergie). Cependant, quel que soit le système envisagé pour remonter l'eau au niveau de sa réserve, la quantité d'énergie apportée par son écoulement serait insuffisante pour alimenter les pompes, même les plus efficaces.
A quantité d'énergie exergonique et endergonique égale, la réserve ne pourrait être reconstituée qu'à une hauteur inférieure à celle du départ. En effet, la transformation et le couplage de l'énergie s'accompagnent toujours de pertes et, seule une partie de l'énergie peut être convertie en travail. Ce premier exemple présente de nombreuses analogies avec les transferts de l'énergie en milieu vivant.
Pour répondre aux besoins de l'organisme, le glycogène (ou glucide) et les triglycérides (ou lipide), formes de réserves d’énergie potentielle situées respectivement dans les muscles et le foie pour les premières, dans les tissus adipeux et dans la fibre musculaire pour les secondes, sont progressivement dégradées en molécules intermédiaires et en leurs deux produits finaux : le dioxyde de carbone (CO₂) et l'eau (H₂0). Par analogie à l'exemple précédent, ces réserves se vident en libérant leur énergie potentielle sous forme de chaleur. L'énergie potentielle qu'elles renferment résulte de leur structure constituée essentiellement d'atomes de carbone (C), d'hydrogène (H) et d'oxygène (O), et des liaisons électroniques qu'entretiennent ces atomes entre eux.
La chaleur correspond à l'énergie cinétique, c'est à dire à la vitesse des mouvements désordonnés des molécules libérées de leurs liaisons électroniques. Autrement dit, l'énergie potentielle qui représente la forme ordonnée de l'énergie s'écoule sous forme d'énergie cinétique (dans le premier exemple) ou de chaleur (dans l’exemple présent) qui sont-elles mêmes deux formes d'énergie désordonnée, dont le « désordre » augmente au cours de leur écoulement. Lorsque l'énergie libérée par les réserves potentielles est totalement dissipée dans le milieu environnant, on dit qu'elle a atteint son entropie maximum, c'est à dire, sont état de désordre maximum.
Lorsque l’état d’entropie maximum est atteint, il n’y a plus d’énergie utilisable. Entre l'état initial, ici le glycogène ou les triglycérides, et l'état final le CO₂ et l’H₂O, a été dissipée une quantité totale de chaleur correspondant à l'enthalpie (H) de chacun des deux composés. L'enthalpie est donc la variation de l'énergie totale contenue dans un composé. Cette variation de l'énergie totale ne présente pas d'intérêt immédiat car, à cause de différentes pertes dont elle est l'objet, elle ne peut être entièrement convertie en travail. La quantité maximale susceptible de l'être est appelée énergie libre « G » (de l'initiale du nom du physicien Willard Gibbs qui, pour la première fois, en a exprimé le concept). Les variations de l'énergie libre qui se produisent au cours d'une réaction, sont représentées par le symbole △G.
Comme en biologie, les variations de l’énergie sont influencées par la pression, la température, la concentration des constituants d'un composé donné et par le niveau d'acidité (pH) du milieu où se déroulent les réactions, on exprime les variations de l'énergie libre en standardisant les conditions du milieu : pression : 1 atmosphère, température : 25° C, concentration : 1 mole par litre, pH 7.
Le symbole s'écrit alors △G°’ correspond aux variations d’énergie libre standard en milieu vivant.
5. Comment l’énergie libérée par l’hydrolyse de l’ATP est utilisée lors de la contraction et l’activité musculaire ?
✎ Synthèse du module 1
1
D'où vient l'énergie biologique dans notre biosphère ?
- L’essentiel de l’énergie provient du soleil et parvient jusqu’à la Terre sous forme d’énergie lumineuse. Sur la terre, par une série de réactions chimiques complexes : par la photosynthèse, les plantes transforment l’énergie lumineuse en énergie chimique.
- L’énergie chimique est elle-même utilisée par les plantes vertes dites chlorophylliennes, pour synthétiser les molécules organiques : glucides, lipides, protéines à partir du dioxyde de carbone (CO2) extrait de l'environnement, de l’eau (H2O) et de l’azote (N) puisées par les racines.
- Comme l’homme se nourrit de plantes et de la chair des animaux qui, eux-mêmes consomment ces plantes, il récupère ainsi l’énergie potentielle contenue dans les molécules organiques synthétisées. La digestion réduit les macromolécules absorbées en leurs unités les plus simples : glucose, acides gras, acides aminés, qui peuvent alors diffuser dans la circulation sanguine.
- Ces molécules les plus simples sont directement utilisées par les tissus qui en ont besoin ou sont mises en réserve sous forme : de glycogène (molécules de glucose agglomérées) dans les muscles et le foie, de gouttelettes lipidiques dans les muscles et de triglycérides (trois acides gras associés à une molécule de glycérol) dans les cellules adipeuses ou graisseuses, aussi appelées adipocytes.
2
Comment l'énergie est-elle libérée ?
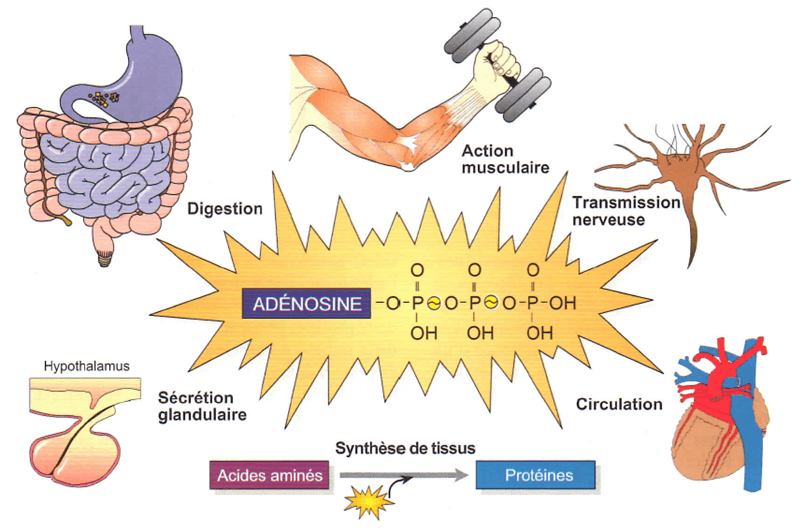
- Seul le catabolisme de la molécule d’ATP (appelé aussi hydrolyse car il intègre une molécule d'eau) en ADP (adénosine diphosphate) et en Pi (phosphate inorganique) permet de libérer l’énergie nécessaire aux différentes formes de travail biologique dont notre organisme est le siège.
- Ces différentes formes de travail sont notamment : mécanique (contraction musculaire), chimique (métabolismes), osmotique (transferts membranaires)
- Les très faibles réserves en ATP de notre organisme nécessitent son constant renouvellement pour répondre aux très importants besoins biologiques qui, dans certaines circonstances comme l’activité sportive, peuvent considérablement augmenter.
- Au sein de la fibre musculaire, les moindres variations du rapport ATP/ADP+AMP enclenchent et régulent dans le sens de leur catabolisme (dégradation) ou de leur anabolisme (synthèse ou reconstitution) les trois principales sources énergétiques constituées par les réserves intracellulaires que constituent les molécules de phosphorylcréatine (PCr), de glycogène et d’acides gras. Le catabolisme de ces molécules libère l’énergie requise par le travail musculaire.
3
Le catabolisme du glycogène et des acides gras
- Alors que le catabolisme de la PCr libère immédiatement son énergie potentielle, plusieurs étapes sont nécessaires pour le glycogène et les acides gras.
- Les premières étapes du catabolisme du glycogène (glycolyse ; lyse = fragmentation) se déroulent dans le cytoplasme cellulaire et ne nécessite pas de dioxygène (glycolyse lactique). Il peut se poursuivre dans les mitochondries en présence obligatoire de dioxygène (glycolyse aérobie).
- Le catabolisme des acides gras (lipolyse) est également réalisé par β-oxydation dans les mitochondries en présence de dioxygène. Dans les mitochondries, le catabolisme des différentes molécules aboutit toujours à la libération d’énergie et à la formation de dioxyde de carbone (CO2) et d’eau (H2O).
- Ainsi, glucides, lipides et secondairement protéines constituent les substrats énergétiques ou « carburants », alors que l’oxygène représente le « comburant » des combustions cellulaires appelées en biologie : oxydation ou respiration cellulaire.
- Les différentes réactions biochimiques intermédiaires de ces catabolismes nécessitent la présence d’enzymes spécifiques qui catalysent (orientent sans être modifiées ou détruites) les réactions et permettent ainsi de libérer « à petit feu » et sans gaspillages excessifs, l’énergie nécessaire à la synthèse de l’ATP.